Introductie tot biosimilars
AMGEN Belux heeft een video gemaakt die in enkele minuten tijd vertelt wat een biosimilar precies is en hoe deze ontwikkeld wordt.
Biosimilars zijn biologische geneesmiddelen
Biologische geneesmiddelen – ook wel biologicals genoemd – zijn therapieën wiens actief bestanddeel wordt geproduceerd door een levend organisme. Dit actief bestanddeel kan gaan van kleinere eiwitten en hormonen tot grote eiwitten met een complexe structuur (bv. monoklonale antilichamen). Biologische geneesmiddelen zijn daarom moeilijker te ontwikkelen en te produceren dan chemische geneesmiddelen, die een eenvoudigere structuur kennen.1,2
| Chemisch geneesmiddel | Biologicals | ||
 |
 |
 |
 |
Acetylsalicylzuur ~ 180 dalton |
Insuline ~ 5.700 dalton |
Groeihormoon 191 aminozuren ~ 22.000 dalton |
Monoklonaal antilichaam (mAb) ~ 1.300 aminozuren ~ 150.000 dalton |
| Chemisch Geneesmiddel | Kleine biological | Grote biological | |
| Moleculaire structuur | Primaire tot quaternaire structuur | ||
Chemische versus biologische geneesmiddelen
De inherente complexiteit van biologische geneesmiddelen – en dus ook van biosimilars – maakt dat de ontwikkeling ervan veel moeilijker is dan die van klassieke, chemische geneesmiddelen. Zo zijn biologische geneesmiddelen sterk gevoelig aan variaties in productieomstandigheden.2
| Verschillen in karakteristieken tussen biologische en chemische geneesmiddelen | |
| Biologische geneesmiddelen | Chemische geneesmiddelen |
|---|---|
| Complexe eiwitten | Moleculaire structuur |
| Grootte: tot 100 à 1000 maal groter dan een chemisch molecule | Kleinere molecule |
| Geproduceerd door een genetisch gemodifieerd organisme | Geproduceerd door een chemisch process |
| Complex en niet perfect dupliceerbaar productieproces | Beperkt aantal productiestappen. Dupliceerbaar proces. |
| Complex werkingsmechanisme | Eenvoudig en direct werkingsmechanisme |
| Moeilijk te isoleren met opzuivering na productie | Eenvoudig te isoleren en op te zuiveren |
| Meestal onstabiel, maar voldoende stabiel om een geneesmiddel te produceren | Stabiel eens productie is afgerond |
Biosimilars: gelijkwaardig, nooit identiek
De video hieronder bespreekt de complexiteit van het produceren van biologische geneesmiddelen en welke impact dit heeft op de ontwikkeling van biosimilars
Bij de ontwikkeling van een biosimilar, moet men het referentieproduct zo goed mogelijk karakteriseren om vervolgens een biosimilar te produceren dat hier sterk op lijkt. Dit is een zeer complex proces.5 Bovendien is het volledige, originele productieproces - met o.a. de gebruikte media, het opzuiveringsproces en formulatiemethodes - bedrijfsspecifiek en niet publiek gekend.6 De biosimilar producent dient dus een eigen productieproces te ontwikkelen, wat in elk geval zal verschillen van het originele proces. Hierdoor kan deze producent enkel een biologisch geneesmiddel ontwikkelen dat zeer sterk gelijkend – en dus niet identiek - is aan het referentie product, waardoor men spreekt over biosimilars.5,7

Europese vereisten tot registratie
De complexiteit van biologische geneesmiddelen maakt ook dat het Europees Geneesmiddelenagentschap (EMA) specifieke soorten data vereist voor de goedkeuring van biosimilars, die bovendien kunnen afwijken naargelang het type molecule. Zo zijn de vereisten en richtlijnen voor een biosimilar van insuline anders dan die voor een monoklonaal antilichaam.6 Deze vereisten verschillen ook ten opzichte van wat gevraagd wordt van een innovatief geneesmiddel. Zo zullen klinische studies bij een innovatief geneesmiddel het grootste deel van het datapakket uitmaken. Bij biosimilars zullen de klinische gegevens eerder beperkt zijn en dienen ze om de biosimilariteit te bevestigen, die reeds grotendeels bewezen werd dankzij het overige deel van het datapakket.2
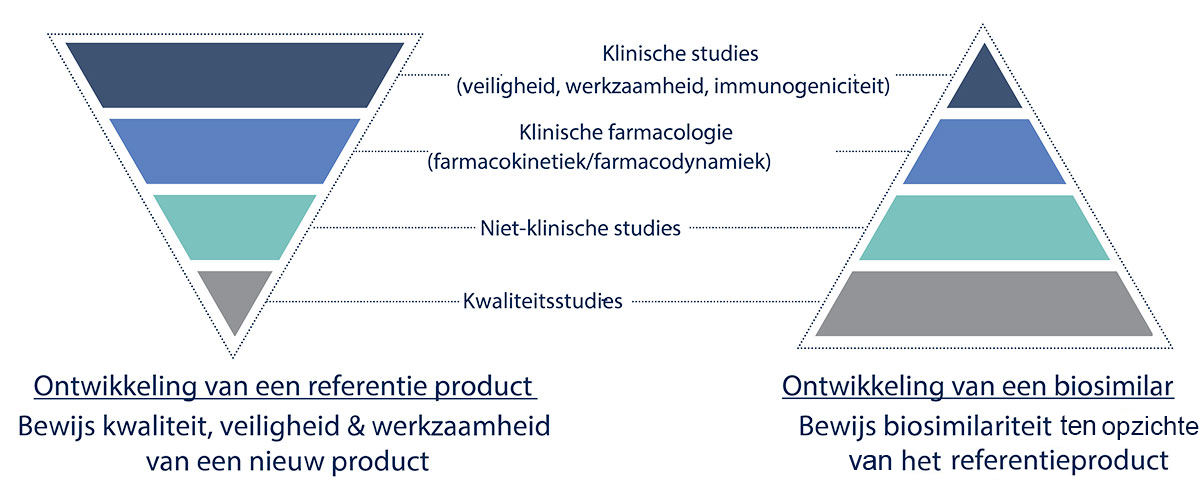
Generische, biosimilars en biologische referentiegeneesmiddelen
Generieke geneesmiddelen zijn niet onderworpen aan klinische studies in tegenstelling tot biosimilars. Het volstaat om aan te tonen dat het product dezelfde kwalitatieve en kwantitatieve samenstelling heeft als het referentieproduct en bio-equivalent is. Dat maakt dat de ontwikkeling van biosimilars langer duurt en duurder is dan die van generieken.7,9
| Generieken | Biosimilars | Originator biologicals | ||
Ontwikkeling |
Wetenschappelijke moeilijkheid | Laag10 | Hoog10 | |
 |
||||
| Biosimilariteit | ||||
| Tijd | Kort | Lang | ||
 |
||||
| (3-4 jaar)9 | ~ 8 jaar9 | (>10 jaar)7 | ||
| Kost | Laag (<$5M) | Hoog (<$1200m) | ||
 |
||||
| Bioequivalentie9 | ~$200 M9 | Volledige klinische ontwikkeling7 | ||
Productie |
Productieproces | Eenvoudig & kort7 | Lang & complex7 | |
 |
||||
| Complex | ||||
Extrapolatie van indicaties
Wanneer een biosimilar gelijkwaardig is aan het referentieproduct en een vergelijkbaar veiligheids- en werkzaamheidsprofiel heeft in één therapeutische indicatie, dan kan dit profiel worden geëxtrapoleerd naar andere goedgekeurde indicaties van het referentieproduct. Dit betekent dat niet in elke indicatie van het referentieproduct een klinische studie moet worden uitgevoerd. Extrapolatie van data naar andere indicaties is steeds ondersteund door wetenschappelijk bewijs gegenereerd door robuuste vergelijkende analyses (van kwalitatieve, niet-klinische en klinische gegevens).2

Biosimilars & Farmacovigilantie
De complexiteit van biologische geneesmiddelen heeft ook gevolgen op gebied van farmacovigilantie. Dit wordt beschreven in de ESMO position paper over Biosimilars:11
“Contrary to generics that are referenced by their INN, the complexity of a biosimilar, including the recording of related adverse events, means that the label must specify the brand name,[...]”
Dit standpunt wordt ook bevestigd door het EMA:2
“For identifying and tracing biological medicines in the EU, medicines have to be distinguished by the tradename and batch number and this is particularly important in cases where more than one medicine with the same INN exists on the market.”
De meerwaarde van biosimilars
Biosimilars kunnen meerwaarde bieden op verschillende gebieden en bijdragen tot een duurzame gezondheidszorg.

Referenties:
- Prugnaud, J.-L. Similarity of biotechnology-derived medicinal products: specific problems and new regulatory framework. Br. J. Clin. Pharmacol. 65, 619–620 (2008)
- European Medicines Agency: Biosimilars in the EU – Information guide for healthcare professionals (2017).
- American Cancer Society Cancer Action Network. Understanding Biologic Medicines from the Cancer Patient Perspective. January 2013.
- Heinrichs M, et al. Am Health Drug Benefits 2008;1(5): 21-262
- Roger SD. Nephrology (Carlton) 2006;11:341–6
- Mellstedt H, et al. Ann Oncol 2008:411–9;
- Ventola CL. P T. 2013;38:270-87
- EMA. Guideline on similar biological medicinal products containing biotechnology-derived proteins as active substance: quality issues (revision 1), 2014.
- Federal Trade Commission. Emerging Health Care Issues: Follow-on Biologic Drug Competition. Published June 2009
- Camacho LH, et al. Cancer Med. 2014;3:889-899.
- Tabernero, J. et al. Biosimilars: a position paper of the European Society for Medical Oncology, with particular reference to oncology prescribers. ESMO Open. 2016;1:e000142. doi:10.1136/esmoopen-2016-000142
- Dörner T, et al. Ann Rheum Dis 2016;75:974–82
