Introduction aux biosimilaires
AMGEN Belux a créé une vidéo qui explique en quelques minutes ce qu’est un biosimilaire et comment il est développé.
Les biosimilaires sont des médicaments biologiques
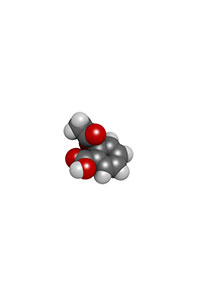
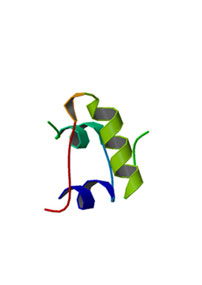
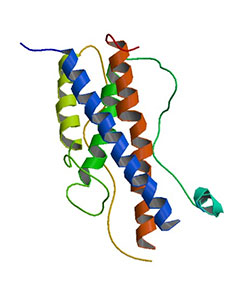
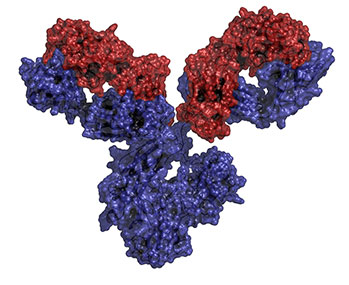
Les médicaments biologiques – également appelés biomédicaments – sont des traitements dont la substance active est produite par un organisme vivant. Celle-ci peut aller de protéines de petite taille à des hormones et à des protéines de grande taille dotées d'une structure complexe (par exemple, les anticorps monoclonaux). Les biologiques sont dès lors souvent plus complexes à développer et à produire que des médicaments chimiques, dont la structure est plus simple.1,2
| Molécule chimique | Biologiques | ||
 |
 |
 |
 |
Acide acétylsalicylique ~ 180 daltons |
Insuline ~ 5.700 daltons |
Hormone de croissance 191 acides aminés ~ 22.000 daltons |
Anticorps monoclonal (mAb) ~ 1.300 acides aminés ~ 150.000 daltons |
| Molécule chimique | Biologique de petite taille | Biologique de grande taille | |
| Structure moléculaire | Structure protéique primaire à quaternaire similaire | ||
Médicaments chimiques vs médicaments biologiques
La complexité inhérente aux médicaments biologiques – tels que les biosimilaires – rend leur développement beaucoup plus difficile que celui des médicaments chimiques classiques. Les médicaments biologiques sont ainsi fortement sensibles aux variations des conditions de production.2
| Les biologiques et les médicaments chimiques ont des caractéristiques différentes | |
| Biologiques | Médicaments chimiques |
|---|---|
| Protéines complexes | Structure moléculaire |
| Taille: jusqu'à 100 à 1.000 fois plus grande qu'une molécule chimique | Plus petites molécules |
| Produit par un organisme vivant génétiquement modifié | Produit par un procédé chimique |
| Procédé de production complexe et pas parfaitement reproductible à l'identique | Nombre limité d'étapes de production. Procédé reproductible. |
| Mécanisme d'action complexe | Mécanisme d'action simple et direct |
| Difficile à isoler par purification après production | Facile à isoler et à purifier |
| Généralement instable, mais suffisamment stable pour produire un médicament | Stable une fois la production terminée |
Les biosimilaires : fort semblables, jamais identiques
Pour développer un biosimilaire, il faut que le médicament original soit caractérisé le mieux possible afin de produire un biosimilaire qui en est fort semblable. Ce processus est très complexe.5 De plus, le procédé de production complet (incluant entre autres les milieux utilisés, le procédé de purification et les méthodes de formulation) est unique et n’est pas rendu public.6 Le fabricant du biosimilaire doit donc développer son propre procédé, qui ne sera jamais identique à l’original. Au final, ce fabricant pourra seulement développer un biosimilaire qui est fort semblable – mais pas identique – au produit original. C'est la raison pour laquelle on parle de biosimilaires.5,7

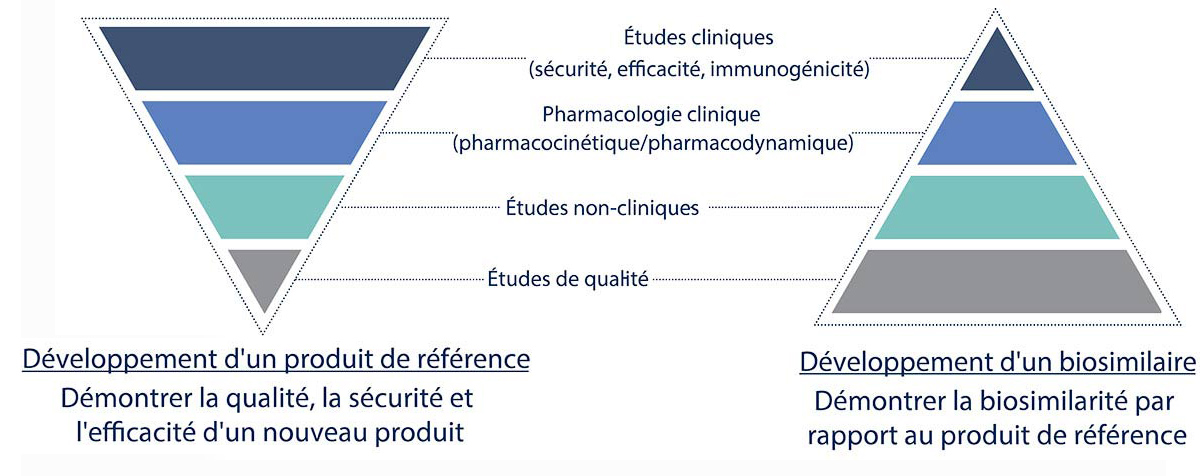
Exigences européennes pour l'approbation
La complexité des médicaments biologiques fait également que l'Agence Européenne des Médicaments (EMA) a des exigences spécifiques en ce qui concerne les données exigées pour l’approbation des biosimilaires; celles-ci peuvent différer en fonction du type de molécule. Par exemple, les exigences et les directives pour un biosimilaire de l'insuline ne sont pas les mêmes que pour un anticorps monoclonal.6 Ces exigences diffèrent également de ce qui est demandé pour un médicament innovant. Pour un médicament innovant, les études cliniques constitueront la plus grande partie des données. Pour les biosimilaires, les données cliniques seront relativement limitées et serviront à confirmer la biosimilarité déjà en grande partie démontrée grâce au reste des données scientifiques.2
Génériques, biosimilaires et produits de référence biologiques
Les médicaments génériques ne sont eux pas soumis à des études cliniques contrairement aux biosimilaires. Il suffit de démontrer que le produit a la même composition qualitative et quantitative que le produit de référence et qu'il est équivalent. Cela rend le développement des biosimilaires plus long et plus coûteux que celui des génériques.7,9
| Génériques | Biosimilaires | Produits biologiques de référence | ||
Développement |
Difficulté scientifique | Faible10 | Élevée10 | |
 |
||||
| Biosimilarité | ||||
| Temps | Court | Long | ||
 |
||||
| (3-4 ans)9 | ~ 8 ans9 | (>10 ans)7 | ||
| Coût | Faible (<$5M) | Élevé (<$1200M) | ||
 |
||||
| Bioéquivalence9 | ~$200 M9 | Développement clinique complet7 | ||
Production |
Procédé de production | Simple & court7 | Long & complexe7 | |
 |
||||
| Complexe | ||||
Extrapolation d'indications
Un biosimilaire étant fortement semblable au produit de référence et ayant un profil de sécurité et d'efficacité comparable dans une indication thérapeutique, ce profil peut être extrapolé à d'autres indications approuvées du produit de référence. Cela signifie que des études cliniques ne sont pas requises dans chaque indication du produit de référence. L’extrapolation de données à d’autres indications est toujours étayée par des preuves scientifiques générées dans des analyses comparatives robustes (à partir de données qualitatives, non-cliniques et cliniques).2

Biosimilaires & pharmacovigilance
La complexité des médicaments biologiques a également des conséquences sur le plan de la pharmacovigilance. Ceci est notamment décrit dans le document de principe de l'ESMO à propos des biosimilaires11:
“Contrary to generics that are referenced by their INN, the complexity of a biosimilar, including the recording of related adverse events, means that the label must specify the brand name,[...]”
Cette position est également adoptée par l'EMA2:
“For identifying and tracing biological medicines in the EU, medicines have to be distinguished by the tradename and batch number and this is particularly important in cases where more than one medicine with the same INN exists on the market.”
La valeur ajoutée des biosimilaires
Les biosimilaires peuvent offrir une valeur ajoutée dans différents domaines et contribuer à la durabilité du système de santé.

Références:
- Prugnaud, J.-L. Similarity of biotechnology-derived medicinal products: specific problems and new regulatory framework. Br. J. Clin. Pharmacol. 65, 619–620 (2008)
- European Medicines Agency: Biosimilars in the EU – Information guide for healthcare professionals (2017).
- American Cancer Society Cancer Action Network. Understanding Biologic Medicines from the Cancer Patient Perspective. January 2013.
- Heinrichs M, et al. Am Health Drug Benefits 2008;1(5): 21-262
- Roger SD. Nephrology (Carlton) 2006;11:341–6
- Mellstedt H, et al. Ann Oncol 2008:411–9;
- Ventola CL. P T. 2013;38:270-87
- EMA. Guideline on similar biological medicinal products containing biotechnology-derived proteins as active substance: quality issues (revision 1), 2014.
- Federal Trade Commission. Emerging Health Care Issues: Follow-on Biologic Drug Competition. Published June 2009
- Camacho LH, et al. Cancer Med. 2014;3:889-899.
- Tabernero, J. et al. Biosimilars: a position paper of the European Society for Medical Oncology, with particular reference to oncology prescribers. ESMO Open. 2016;1:e000142. doi:10.1136/esmoopen-2016-000142
- Dörner T, et al. Ann Rheum Dis 2016;75:974–82
